ธาตุคาร์บอนเป็นธาตุที่พบมากที่สุดในโลก
ปฏิกิริยาการเผาไหม้ ** สารอินทรีย์+O2 ได้ CO2 กับ H2O
มี O2 เพียงพอ เรียกว่าการเผ่าไหม้สมบูรณ์
มี O2 ไม่เพียงพอเรียกว่าการเผาไหม้ไม่สมบูรณ์
เขม่า เกิดจากการเผาไหม้ไม่สมบูรณ์
บทนำ
แรงทางเคมีมี 2 ชนิด
คือ 1. แรงภายในโมเลกุล (First Force) - ใช้อธิบายสมบัติทางเคมี
2. แรงภายนอกโมเลกุล (Second Force) - ใช้อธิบายสมบัติทางกายภาพ
แรงภายในมี มี 3 ชนิด คือ
1. พันธะไอออนิก
2. พันธะโควาเลน
3. พันธะโลหะ
แรงภายนอกมี มี 2 ชนิด คือ
1. แรงแวนเดอวาลล์ - แรงที่ขึ้นอยู่กับมวล
1.1 แรงลอนดอล หรือ แรงแผ่กระจาย(Dispersion Force) สารที่ไม่มีขั้ว
1.2 แรงดีโพลดีโพล สารที่มีขั้ว
2. พันธะไฮโดรเจน - แรงที่ไม่ขึ้นกับมวล
**สารได้ที่มีพันธะไฮโดรเจน จะมีจุดเดือดจุดหลอมเหลวสูง
การเดือด คือ การทำลัยแรงระหว่างโมเลกุล
**การเดือดเป็นการทำลายพันธะไฮโดรเจน
การตัดสินจุดเดือดจุดหลอมเหลวว่าสูงหรือต่ำ ให้ดูจากแรงยึดระหว่างตัวเองกับตัวเอง
การตัดสินการละลายว่าสูงหรือต่ำ ให้ดูจากแรงยึดระหว่างตัวเองกับตัวทำละลาย
พันธะซิกมา พันธะพาย
อิเล็กตรอนที่เกิด Hybridization แล้วจะเกิด พันธะซิกมา
พันธะซิกมาคือพันธะ เดี่ยว
sp3 ไฮบริดออร์บิทัลเกิดจากออร์บิทัล 2s รวมกับ 2px 2py และ 2pz จัดตัวใหม่จะเกิดเป็นพันธะเดี่ยวทั้งหมด รูปร่างที่ได้จะเป็นทรงสี่หน้า โดยมีมุมระหว่างแกนทั้งสีของออร์บิทัลเท่ากับ 109.5 องศา
พันธะคู่จะมีทั้งอิเล็กตรงซิมมาและพาย
sp2
วิธีเขียนสูตรโครงสร้างของสารอินทรีย์
มี 4 ประเภท
1. สูตรโมเลกุล เช่น C6H6O6
2. สูตรแบบจุดหรือแบบเส้น
3. สูตรแบบย่อ
4. สูตรแบบเส้นและมุม
ประเภทของสารประกอบ C
1. ใช้ลักษณะปฏิกิริยาเป็นเกณฑ์
1.1 Saturated Compounds อิ่มตัว เป็นพันธะซิกมาทั้งหมด
1.2 Unsaturated Compounds ไม่อิ่มตัว
2. โครงสร้างเป็นเกณฑ์
2.1 Aliphatic Compounds แบบโซ่เปิดมีหัวมีท้าย
2.1.1 Straight Chain แบบตรง
2.1.2 Branched Chain แบบกิ่ง
2.2 Ali cyclic Compound แบบโซ่ปิด
3. Aromatic Compounds
คือ Ali cyclic Compound ที่มี จำนวน อิเล็กตรอนพาย = 4n+2 แล้ว n เป็นจำนวนเต็ม
**** เป็นทฤษฎีมีชื่อว่า Huckle's Rule
4. Hetero cyclic Compounds โว่ปิดที่ไม่ได้ประกอบด้วย C ทั้งหมด
ปฏิกิริยาสารประกอบอินทรีย์
คือการสร้างการทำลายหรือการแตกพันธะของพันธะโควาเลนต์โดยผ่านตัวกลางคือ สารมัธยันตร์
ประเภทของปฏิกิริยาเคมีอินทรีย์
1. ปฏิกิริยาแทนที่ เป็นเฉพาะสารประกอบ C ที่อิ่มตัวแล้ว(ไม่มีที่ให้เติม)
2. ปฏิกิริยาการเติม เป็นเฉพาะสารประกอบ C ที่ไม่อิ่มตัว(พันธะพาย เปี่ยนเป็นพันธะซิกมา)
3. ปฏิกิริยาการขจัดออก เปี่ยนจากพันธะซิกมาเป็นพันธะพาย
4. ปฏิกิริยาการจัดเรียงตัวใหม่ โซ่ตรงเป็นโซ่กิ่ง
5. ปฏิกิริยาพอลิเมอไรเซชัน ทำให้ C มีโมเลกุลใหญ่ขึ้น
6. ปฏิกิริยาการแตกตัว ทำให้ C โมเลกุลใหญ่เป็นโมเลกุลเล็ก
สารประกอบอัลเคน(Alkanes)
อัลเคนเป็นสารประกอบไฮโดรคาร์บอนที่มีสูตรทั่วไปเป็น CnH2n+2สำหรับอัลเคนที่เป็นโซ่เปิด และ CnH2nสำหรับ
อัลเคนที่เป็นโซ่ปิด
(อัลคิล:Alkyl: R อัลเคนที่เอาHออก1อะตอม เป็นแขนว่างไว้สำหรับเชื่อมพันธะกับสารอื่นๆ)
2. การเรียกชื่อ
การเรียกชื่อสารประกอบอัลเคนนั้น จะเรียกได้2ประเภทคือ ชื่อสามัญและชื่อ IUPAC ซึ่งชื่อIUPACนั้นจะเป็นชื่อที่ยอมรับกันทั่วไป
ก่อนอื่นต้องรู้จักชื่อบ่งบอกจำนวนคาร์บอนในแต่ละโมเลกุลก่อน
C-1 = Meth-
C-2 = Eth-
C-3 = Prop-
C-4 = But-
C-5 = Pent-
C-6 = Hex-
C-7 = Hept-
C-8 = Oct-
C-9 = Non-
C-10= Dec-
2.1 ชื่อสามัญ
นัก เคมีนิยมตั้งขึ้นเพื่อใช้เรียกสารที่มีสูตรโครงสร้างไม่ซับซ้อน และเป็นโครงสร้างเล็กๆ โดยบ่งบอกถึงลักษณะการจัดเรียงอะตอมของคาร์บอนในลักษณะที่เป็น Structural isomers

normal pentane
isopentane
neopentane
2.2 การเรียกชื่อหมู่อัลคิล
หมู่อัลคิลคือหมู่ที่เกาะกับโซ่หลักทำใ้ห้เกิดเป็นแขนงขึ้น
ข้อตกลง : 1. คำนำหน้า n- ย่อมาจาก normal คือหมู่อัลคิลที่เป็นโซ่ตรง
2. คำนำหน้า iso- ใช้กับหมู่อัลคิลที่มีmethylเกาะอยู่ที่คาร์บอนตัวรองสุดท้าย นับจากปลายที่ห่าง จากปลายที่จะไปเชื่อมกับโซ่หลัก
3. คำนำหน้า sec- ย่อมาจาก secondary ใช้กับหมู่อัลคิลที่มีจุดต่อ ณ ตำแหน่งที่เป็นคาร์บอน ทุติยภูมิ
4. คำนำหน้า tert- ย่อมาจาก tertiary ใช้กับหมู่อัลคิลที่มีจุดต่อ ณ ตำแหน่งที่เป็นคาร์บอนตติย -ภูมิ
2.3 การเรียกชื่อ IUPAC
1. นับจำนวนคาร์บอนที่ติดต่อกันยาวที่สุดเป็นโซ่หลัก ที่เหลือเป็นหมู่อัลคิล
2. ตำแหน่งโซ่หลักเริ่มต้นจากด้านที่หมู่อัลคิลมาเกาะก่อน
3. บอกตำแหน่งพร้อมชื่อหมู่อัลคิลที่มาเกาะหน้าชื่อโซ่หลัก โดยระหว่างเลขกับเลขใช้เครื่องหมาย , ส่วนเลขกับอักษรใช้เครื่องหมาย -
4. เมื่อมีหมู่อัลคิลมาเกาะที่โซ่หลักมากกว่า1หมู่ ให้เรียกชื่อโดยเรียงลำดับอักษรภาษาอังกฤษ
เพิ่มเติม : mono , di , tri , ... ไม่นับเรียงอักษร
sec-,tret-,n-,... ไม่นับเรียงอักษร
iso-,neo-,cyclo- นับเรียงอักษร
5. ถ้ามีหมู่อัลคิลมาเกาะมากกว่า1หมู่ ที่คาร์บอนอะตอมเดียวกัน ให้บอกลำดับเลขนั้นซ้ำ
6. เมื่อมีอัลคิลชนิดเดียวกันมาเกาะที่โซ่หลักเดียกันให้ใช้คำนำหน้าว่า di.tri.tetra บอกจำนวนที่หมู่อัลคิลเหมือนกัน
7. ในกรณีที่โซ่หลักเลือกได้มากกว่า1ทาง ซึ่งมีจำนวนคาร์บอนเท่ากัน ให้เลือกโซ่หลักที่มีหมู่อัลคิลมาเกาะมากที่สุด
8. ในกรณีที่หมู่อัลคิลห่างจากปลายโซ่เท่าๆกัน ให้เลือกตำแหน่งที่มีผลรวมของเลขทั้งหมดน้อยที่สุึด
9. ถ้าหากมีหมู่ฮาโลเจนมาเกาะ ให้เรียกหมู่ฮาโลเจนนั้นก่อน
ตัวอย่าง!!!
อ่านชื่อว่า 2,2,4 - trimethypentane
สมบัติทางกายภาพ
1.แอลคีนโมเลกุลเล็กๆ (มี C 2-4 อะตอม) จะเป็นก๊าซ เมื่อขนาดโมเลกุลใหญ่ขึ้น (มีจำนวนคาร์บอนมากขึ้นเป็น 5 - 18 อะตอม) จะเป็นของเหลว และถ้าขนาดใหญ่กว่านี้จะเป็นของแข็ง
2.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว จึงไม่ละลายในตัวทำละลายมีขั้ว เช่น น้ำ แต่ละลายได้ดีในตัวทำละลายไม่มีขั้วเช่น เบนซีน โทลูอีน
3.ไม่นำไฟฟ้าในทุกสถานะ
4.มีกลิ่นเฉพาะตัว เช่น C2H4 เมื่อดมมากๆ อาจสลบได้
5.มีความหนาแน่นน้อยกว่าน้ำ (ความหนาแน่นสูงสุดไม่เกิน 0.8 g/cm3) เมื่อมวลโมเลกุลเพิ่มขึ้น ความหนาแน่นจะเพิ่มขึ้น (ตารางที่ 10.15)
6.จุด เดือดจุดหลอมเหลวต่ำ เพราะมีแรงยึดเหนี่ยวระหว่างโมเลกุลเพียงชนิดเดียวคือ แรงแวนเดอร์วาลส์ เมื่อมวลโมเลกุลเพิ่มขึ้นหรือเมื่อจำนวนอะตอมของคาร์บอนเพิ่มขึ้น จุดเดือดจะเพิ่มขึ้น ทั้งนี้เพราะแรงแวนเดอร์วาลส์เพิ่มขึ้น
7.จุดเดือดและจุดหลอมเหลวของแอลคีนที่มีคาร์บอนเท่ากับแอลเคนและมีโครงสร้างเหมือนกันจะต่ำกว่าของแอลเคน
การเตรียมสารประกอบอัลเคน
1. Hydrogenation of Alkenes or Alkynes
เป็นการเตรียมสารประกอบอัลเคนโดยการเติม H เข้าไปในพันธะไพของสารประกอลอัลคีน หรือสารประกอบอัลไคลน์ โดยตัวเร่งปฏิกิริยาเป็นโลหะ

2. Hydrogenation of Alkylhaide
เป็นการเตรียมสารประกอบโดยให้สารประกอบอัลคิลเฮไดด์ ทำปฏิกิริยากับ H โดยมีโลหะเป็นตัวเร่งปฏิกิริยา

ปฏิกิริยา อัลเคน
อัลเคนเป็นสารประกอบที่อิ่มตัวแล้วจึงไม่ค่อยมีปฏิกิรยากับสารอื่นๆ
1. Halogenation of Alkanes ปฏิกิริยาฟอกจางสี
เป็นปฏิกิริยาแทนที่ H ในอับเคนด้วย ฮาโลเจน(X) เกิดเป็นอัลคิลเฮไลด์ โดยมีความร้อนแสง เป็นตัวเร่งปฏิกิริยา

2. Combustion reaction
ถ้าเผาไหม้สมบูรณ์ (O2มากพอ) อัลเคนจะสันดาปกับO2 จนได้CO2 และน้ำ
ถ้าเผาไหม้ไม่สมบูรณ์(O2ไม่พอ) จะได้คาร์บอนมอนอกไซด์ น้ำ และคาร์อนที่เหลือเป็นเขม่า
**Alkene เผาไม่มีเขม่าเพราะ เปนพันธะ ซิกมา
สารประกอบไซโคลอัลเคน
การเรียกชื่อ
ใช้หลักเกณฑ์เดียวกับโซ่ตรงแต่ต้องมีคำว่า Cyclo นำ หน้าโซ่หลัก (หากมีโซ่ตรงยาวกว่าโซ่ปิด โซ่ปิดจะกลายเป็นกิ่ง) ส่วนการนับกิ่งถ้ามีเพียงกิ่งเดียว ไม่ต้องมีเลข 1 หน้าหมู่อัลคิลเพราะจะเป็นที่รู้ว่ากันว่าเป็นตำแหน่งที่ 1 การให้ตำแหน่งหมู่อัลคิลนั้น จะให้ตำแหน่งโดยผลรวมของตำแหน่งต้องน้อยที่สุด
ตัวอย่าง!!!

ปฎิกิริยาของสารประกอบไซโคลอัลเคน
ในวงขนาดเล็ก เช่น cyclopropane จะ มีความเครียดภายในสูง สามารถเกิดปฎิกิริยาได้โดยการแตกวง แต่หากวงใหญ่ขึ้น ความเครียดภายในลดลง การเกิดปฎิกิริยาจึงเป็นไปได้ยากกว่า การเกิดปฎิกิริยาแบบแทนที่ โดยใช้พลังงานความร้อนหรือแสงเป็นตัวเร่ง

สารประกอบอัลคัน (Alkenes)
สารประกอบอัลคีน คือ สารประกอบไฮโดรคาร์บอนที่มีพันธะไพอยู่ในโมเลกุล 1 เเห่ง
สูตรอัลคีนโซ่เปิด : CnH2n
สูตรอัลคีนโซ่ปิด : CnH2n-2
การเรียกชื่อ





การเรียกชื่อสามัญ
ใช้เรียกสารประกอบอัลคีนตัวเล็กๆ ทำได้โดยเปลี่ยนคำลงท้าย-ane เป็น -ylene เช่น

การเรียกชื่อ IUPAC
ใช้ หลักการเดียวกับการอ่านชื่อสารประกอบอัลเคน โดยเปลี่ยนคำลงท้ายเป็น-ene ให้ตำแหน่งพันธะคู่เป็นตัวเลขระบุตำแหน่งที่น้อยที่สุด แต่ถ้าเป็น cycloalkenes ตำแหน่งของพันธะคู่จะเป็นตำแหน่งที่1เสมอ

* หมู่Alkenylที่พบบ่อย เช่น

2.2.1 การแทนที่ไฮโดรเจนด้วยหมู่alkyl2หมู่
การ แทนที่ลักษณะนี้จะมองในรูปแบบของสารประกอบที่เป็นอนุพันธ์ของ Ethylene ซึ่งก่อให้เกิด ไอโซเมอร์เชิงเรขาคณิต (Geometrical Isomer)ซึ่งมีการเรียกชื่อในระบบ cis- และ trans-

การอ่านชื่อ

สมบัติทางกายภาพ











-สารประกอบอัลคีนที่มีคาร์บอนน้อยกว่า5อะตอม จะระเหยง่ายที่อุณหภูมิห้อง
-สารประกอบอัลคีนจะละลายน้ำได้ในตัวทำละลายอินทรีย์
-จุดเดือดจุดหลอมเหลว มากกว่า สารประกอบอัลเคน
ความเสถียร

การเตรียมสารประกอบอัลคีน
Dehydrohalogenation of Alkylhalides by alc. KOH

Dehydration of Alcohols

Reduction of Alkynes

ปฏิกิริยาของสารประกอบอัลคีน
Addition Reaction of Alkenes
1.Halogenation of Alkenes

2.Hydrogenation of Alkenes

3.Hydrohalogination of Alkenes(Markovnikov's Rule)

*** ไฮโดรเจนจะเข้าที่ตำแหน่งที่มีไฮโดรเจนมากอะตอม ส่วนอะตอมของฮาโลเจนจะเข้าอีกข้างหนึ่ง ***
Hydration of Alkenes

Hydroxylation of Alkenes(Oxidation reaction/Glycol formation reaction)

Ozonolysis of Alkenes

*** จะเป็นaldehyde หรือ ketone ดูที่อัลคีนมีลักษณะอย่างไร ***
Polymerization

สารประกอบอัลไคน์ Alkynes
แอลไคน์ เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวเหมือนแอลคีน ในโมเลกุลของแอลไคน์จะต้องมีพันธะสามระหว่าง C กับ C (C C)
ถ้ามีพันธะสาม 1 แห่ง จะมีสูตรทั่วไปเป็น CnH2n - 2 เมื่อ n = 2, 3, ….สารตัวแรกในอนุกรมแอลไคน์ คือ C2H2 เรียกว่าอะเซติลีน
(acetylene) หรือ อีไทน์ (ethyne) ลักษณะโมเลกุลเป็นเส้นตรงอยู่ในระนาบเดียวกันมุมระหว่างพันธะ 1800

CHCH acetylene
CHC-CH3 methylacetylene
CHC - CH2 - CH3 ethylacetylene
CH3 - C C - CH3 dimethylacetylene
methylisopropylacetylene
ชื่อ IUPAC ใช้เรียกโมเลกุลที่ใหญ่และซับซ้อนได้ โดยใช้หลักการอย่างเดียวกับการเรียกชื่อแอลคีน แต่เปลี่ยนคำลงท้ายเป็น -yne เลือกโครงสร้างหลักยาวที่สุดที่มีพันธะสามก่อน บอกตำแหน่งของพันธะสามด้วยเลขที่น้อยที่สุด หลังจากนั้นจึงจะพิจารณาส่วนอื่นๆ ที่มาต่อกับโครงสร้างหลัก

ถ้ามีพันธะสาม 1 แห่ง จะมีสูตรทั่วไปเป็น CnH2n - 2 เมื่อ n = 2, 3, ….สารตัวแรกในอนุกรมแอลไคน์ คือ C2H2 เรียกว่าอะเซติลีน
(acetylene) หรือ อีไทน์ (ethyne) ลักษณะโมเลกุลเป็นเส้นตรงอยู่ในระนาบเดียวกันมุมระหว่างพันธะ 1800

การเรียกชื่ออัลไึคน์
ชื่อสามัญ ใช้เรียกชื่อแอลไคน์ในโมเลกุล เล็กๆ โดยเรียกเป็นอนุพันธ์ของอะเซทิลีน ให้โครงสร้างของอะเซทิลีนเป็นหลักและถือว่าส่วนที่ต่ออยู่กับ C C เป็นหมู่ แอลคิล การเรียกชื่อสามัญให้เรียกชื่อหมู่แอลคิลก่อนแล้วลงท้ายด้วย อะเซทิลีน ตัวอย่างเช่นCHCH acetylene
CHC-CH3 methylacetylene
CHC - CH2 - CH3 ethylacetylene
methylisopropylacetylene
ชื่อ IUPAC ใช้เรียกโมเลกุลที่ใหญ่และซับซ้อนได้ โดยใช้หลักการอย่างเดียวกับการเรียกชื่อแอลคีน แต่เปลี่ยนคำลงท้ายเป็น -yne เลือกโครงสร้างหลักยาวที่สุดที่มีพันธะสามก่อน บอกตำแหน่งของพันธะสามด้วยเลขที่น้อยที่สุด หลังจากนั้นจึงจะพิจารณาส่วนอื่นๆ ที่มาต่อกับโครงสร้างหลัก
สมบัติทางกายภาพของอัลไคน์ (Physical Properties)
1.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว 2.แอลไคน์ที่มีขนาดโมเลกุลเล็กๆ เป็นก๊าซมีกลิ่นเฉพาะตัว ไม่มีสี
3.ไม่ละลายน้ำ แต่ละลายในตัวทำละลายไม่มีขั้ว เช่น เบนซีน โทลูอีน
4.มีความหนาแน่นน้อยกว่าน้ำ
5.จุดเดือดและจุดหลอมเหลวต่ำ เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย สำหรับแอลไคน์ที่คาร์บอนต่อกันเป็นสายยาว
จุดเดือดจะเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้น
6.จุดเดือดของแอลไคน์สูงกว่าของแอลคีนและแอลเคนที่มีคาร์บอน เท่ากัน และมีโครงสร้างลักษณะเดียวกัน โดยมีลำดับจุดเดือดเป็นดังนี้
จุดเดือด : Alkyne > Alkanes > Alkenes
การเตรียมสารอัลไคน์
1.dehydrohalogenation of alkylhalide โดยนำ alkyl dihalide ทำปฏิกิริยากับ KOH หรือ NaOH ในแอลกอฮอล์
เช่น


 สารประกอบอโรมาติก (Aromatic Compounds)
สารประกอบอโรมาติก (Aromatic Compounds)



 เรียกว่า o-ethyltoluene
เรียกว่า o-ethyltoluene

 napthalene
napthalene
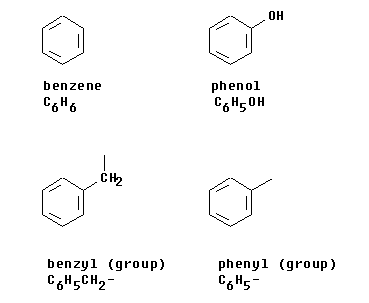








1.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว 2.แอลไคน์ที่มีขนาดโมเลกุลเล็กๆ เป็นก๊าซมีกลิ่นเฉพาะตัว ไม่มีสี
3.ไม่ละลายน้ำ แต่ละลายในตัวทำละลายไม่มีขั้ว เช่น เบนซีน โทลูอีน
4.มีความหนาแน่นน้อยกว่าน้ำ
5.จุดเดือดและจุดหลอมเหลวต่ำ เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย สำหรับแอลไคน์ที่คาร์บอนต่อกันเป็นสายยาว
จุดเดือดจะเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้น
6.จุดเดือดของแอลไคน์สูงกว่าของแอลคีนและแอลเคนที่มีคาร์บอน เท่ากัน และมีโครงสร้างลักษณะเดียวกัน โดยมีลำดับจุดเดือดเป็นดังนี้
จุดเดือด : Alkyne > Alkanes > Alkenes
การเตรียมสารอัลไคน์
1.dehydrohalogenation of alkylhalide โดยนำ alkyl dihalide ทำปฏิกิริยากับ KOH หรือ NaOH ในแอลกอฮอล์

เช่น

|

เช่น

อะโรมาติกเป็นไฮโดรคาร์บอนที่มีโครงสร้างเป็นวง เช่น เบนซีน(C6H6) อะโรมาติกเป็นสารที่ไม่อิ่นตัว แต่มีความเสถียร เนื่องจากสามารถเกิดการรีโซแนนซ์ได้

สารที่เป็นอะโรมาติก จะต้องเป็นไปตามสมการนี้
.....จำนวนอิเล็กตรอนไพ = 4n+2 โดยที่ nเป็นจำนวนนับ.....
2. การเรียกชื่อ
2.1 สารประกอบอะโรมาติกที่มีหมู่มาเกาะ1หมู่

2.2 สารประกอบอะโรมาติกเบนซีนที่มีหมู่มาเกาะ2หมู่
เมื่อ มีหมู่มาเกาะที่ตำแหน่ง 1,2 เรียกว่า Ortho- (o-), ตำแหน่งที่ 1,3 เรียกว่า meth- (m-) , ตำแหน่งที่ 1,4 เรียก para- (p-) โดยที่ตำแหน่งที่1เป็นคาร์บอนที่มีหมู่ฟังก์ชันของสารประกอบหลัก

เช่น
 เรียกว่า o-ethyltoluene
เรียกว่า o-ethyltoluene2.3 สารประกอบอะโรมาติกเบนซีนที่มีหมู่มาเกาะมากกว่า2หมู่
ให้ใช้ตำแหน่งในการเรียกชื่อโดยตำแหน่งที่1เป็นของคาร์บอนที่มีหมู่ฟังก์ชันของสารประกอบหลัก
ความสำคัญ : COOH > SO3H > CHO > CN > CO > OH > NH2 > R > NO2 > X
เช่น

2.4 สารประกอบอะโรมาติกอื่นๆ
 napthalene
napthalene2.5 สารประกอบที่มีวงเบนซีนเป็นหมู่แทนที่
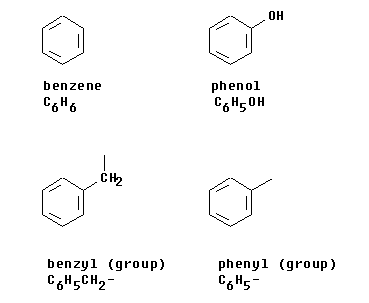
3. ปฏิกิริยาของสารประกอบอะโรมาติก
3.1 ปฏิกิริยาแทนที่ด้วยอิเล็กโตรไฟล์
3.1.1 Halogenation of Benzene

3.1.2 Nitration of Benzene

3.1.3 Silfonation of Benzene

3.1.4 Friedel-Crafts Alkylation (เติมหมู่อัลคิลลงไป)

3.2 ปฏิกิริยาของเบนซีนทีี่มีหมู่อะตอมเกาะอยู่แล้ว1หมู่
3.2.1 Ortho and Para Directing group
หมู่ ที่เกาะจำต้องลงที่ตำแหน่ง o- หรือ p- เท่านั้น โดยตัวที่เกาะอยู่ตอนแรกที่ทำให้ตัวต่อไปมาเกาะตำแหน่งนั้น เช่น benzene-R , benzene-X , benzene-OH
3.2.2 Meta Directing group
หมู่ ที่จะมาเกาะจะต้องลงที่ตำแหน่งm- เท่านั้น โดยตัวที่เกาะอยู่ตอนแรกที่ทำให้ตัวต่อไปมาเกาะตำแหน่งนั้น เช่น benzene-COOH , benzene-NO2 , benzene-SO3H
3.3 ปฏิกิริยาอื่นๆของสารประกอบอะโรมาติก
3.3.1 Oxidation Reaction of Alkylbenzene
**** หมู่อัลคิลต้องไม่ใช่คาร์บอนประเภทตติยภูมิ****
3.3.2 ปฏิกิริยาออกซิเดชันของอนุพันธ์อัลคิลเบนซีนที่มีหมู่อะตอมมาเกาะอยู่

3.3.3 Polymerization of styrene

3.3.4 ปฏิกิริยาระหว่าง Toluene กับ กรดไนตริกเข้มข้น

#เริ่มเมื่อ 16 ธ.ค. 54
#แก้ไขครั้งที่1 19 ธ.ค. 54
#แก้ไขครั้งที่2 14 ก.พ. 55
#แก้ไขครั้งที่3 15 ก.พ. 55

