กรด-เบส
26 สิงหาคม 2554
อาร์เรเนียส เป็นนักวิทยาศาสตร์ชาวสวีเดน ได้ตั้งทฤษฎีกรด - เบส ในปี ค. ศ. 1887 ( พ. ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ (Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำ และให้นิยามกรดไว้ว่า
“ กรด คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน” เช่น
HCl (g)
HClO 4(l)
CH 3COOH (l)
H 2SO 4 (l)
H 2CO 3 (l)
“ เบสคือ สารที่ละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน” เช่น
NaOH (s)
Ca(OH) 2 (s)
KOH (s)
NH 4OH (l)
ข้อจำกัดของทฤษฎีกรด - เบส อาร์เรเนียส
- ทฤษฎีกรด - เบส อาร์เรเนียส จะเน้นเฉพาะการแตกตัวในน้ำ ให้เป็น H + และ OH - ไม่รวมถึงตัวทำละลายอื่นๆ ทำให้อธิบายความเป็นกรด- เบสได้จำกัด
- สารที่จะเป็นกรดได้ต้องมี H + อยู่ในโมเลกุล และสารที่จะเป็นเบสได้ก็ต้องมี OH - อยู่ในโมเลกุล
ทฤษฎีกรด-เบสของเบรินสเตด ลาวรี
กรด คือ สารที่สามารถให้โปรตอน (proton donor) แก่สารอื่น
เบส คือ สารที่สามารถรับโปรตอน (proton acceptor) จากสารอื่น
ปฏิกิริยาระหว่างกรดกับเบสจึงเป็นการถ่ายเทโปรตอนจากกรดไปยังเบสเช่นแอมโมเนียละลายในน้ำ
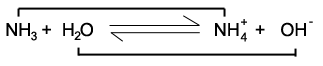
NH3(aq) + H2O(1) = NH4+ (aq) + OH-
base 2 acid 1 acid 2 base 1
ในปฏิกิริยาไปข้างหน้า NH3 จะเป็นฝ่ายรับโปรตอนจาก H2O ดังนั้น NH3 จึงเป็นเบสและH2O เป็นกรด แต่ในปฏิกิริยาย้อนกลับ NH4+ จะเป็นฝ่ายให้โปรตอนแก่ OH- ดังนั้น NH4+จึงเป็นกรดและ OH-
คู่กรด-เบส
สารที่เป็นคู่กรด-เบสกัน H+ ต่างกัน 1 ตัว โดยที่ คู่กรดจะมี H+ มากกว่าคู่เบส 1 ตัว
ในปฏิกิริยาที่ผันกลับได้จะมีปฏิกิริยาย่อย 2 ชนิด คือ ปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับซึ่งในสารละลายกรดและสารละลายเบสจะมีสารที่เรียกว่าคู่กรด-เบสเสมอไม่ว่าจะเป็นปฏิกิริยาใดโดยพิจารณาจากทฤษฎีกรด-เบสของเบรินสเตด-ลาวรี เช่น

H2O เป็นคู่กรดของเบสOH-
NH3 เป็นคู่เบสของกรด NH4+

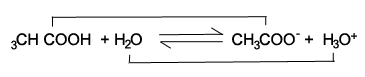
CH3COOH เป็นคู่กรดของเบสCH3COO-
ความแรงของกรด-เบส
เปรียบเทียบได้ดังนี้1. ดูจากการแตกตัวของกรด
พิจารณาค่าการแตกตัวของกรดและเบสนั้น นอกจากจะคิดจากเปอร์เซ็นต์การแตกตัว หรืออาจจะดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส (Ka หรือ Kb) เช่น
ความแรงของเบส พิจารณาจากค่า Kb กล่าวคือ ถ้ามีค่า Kb มาก มีความเป็นเบสมากกว่า Kb น้อย
เช่น
EX
สารละลายกรด 4 ชนิด มีค่าคงที่ของการแตกตัวของกรดเป็นดังนี้
HClO 2 K a = 1.1 x 10 -2
HF K a = 6.8 x 10 -4
CH 3COOH K a = 1.8 x 10 -5
H 2CO 3 K a = 4.4 x 10 -7
ความแรงของกรดเรียงลำดับจากมากไปหาน้อยตามค่า K a ได้ดังนี้
HClO 2 > HF > CH 3COOH > H 2CO 3
ในทำนองเดียวกัน ความแรงของเบส ก็พิจารณาจากค่า K b กล่าวคือ ถ้ามีค่า K b มาก มีความเป็นเบสมากกว่า K b น้อย เช่น
NH 3 K b = 1.76 x 10 -5
N 2H 4 K b = 9.5 x 10 -7
C 6H 5NH 2 K b = 4.3 x 10 -10
ความเป็นเบส NH 3 > N 2H 4 > C 6H 5NH 2
2. ดูจากความสามารถในการให้และรับโปรตอน
กรดแก่ ได้แก่ กรดที่ให้โปรตอนได้มาก
กรดอ่อน ได้แก่ กรดที่ให้โปรตอนได้น้อย
เบสแก่ ได้แก่ เบสที่รับโปรตอนได้มาก
เบสอ่อน ได้แก่ เบสที่รับโปรตอนได้น้อย
สำหรับคู่กรด-เบสคู่หนึ่ง ถ้ากรดเป็นกรดแก่ คู่เบสจะเป็นเบสอ่อน เช่น
HCl (aq) + H 2O ---> H 3O + (aq) + Cl - (aq)
3.ดูจากการเรียงลำดับในตารางธาตุ
พิจารณาความแรงของกรดและเบสดูจากการเรียงลำดับของธาตุที่อยู่ในกรดนั้น ตามตารางธาตุ ซึ่งแบ่งออกได้เป็น
3.1 กรดออกซี หมายถึง กรดที่ประกอบด้วย H, O และธาตุอื่นอีก เช่น HNO 3 H 3PO 4 H 3AsO 4 HClO 4 ถ้าจำนวนอะตอมออกซิเจนเท่ากัน ความแรงของกรดเรียงลำดับดังนี้
ดังนั้น H 2SO 4 > H 2SeO 4 , H 3PO 4 > H 3AsO 4
3.2 กรดที่ไม่มีออกซิเจน เช่น HCl, HBr, HF, และ HI ความแรงของกรดแรงลำดับดังนี้
HI > HBr > HCl > HF
H 2S > H 2O
การแตกตัวของกรดแก่และเบสแก่
การแตกตัวของกรดแก่และเบสแก่ จะแตกตัวได้หมด 100% หมายถึง การแตกตัวของกรดแก่และเบสแก่ เป็นไอออนได้หมดในตัวทำละลายซึ่งส่วนใหญ่เป็นน้ำ เช่น การแตกตัวของกรด HCl จะได้ H + หรือ H 3O + และ Cl - ไม่มี HCl เหลืออยู่ หรือการแตกตัวของเบส เช่น NaOH ได้ Na + และ OH - ไม่มี NaOH เหลืออยู่
การแตกตัวของกรดแก่และเบสแก่นั้น เขียนแทนด้วยลูกศร ® ซึ่งแสดงการเปลี่ยนแปลงไปข้างหน้าเพียงอย่างเดียว เช่น
HCl (aq) → H +(aq) + Cl - (aq)
1 โมล 1 โมล 1 โมล
[HCl] = [H +] = [Cl -] = 1 โมล/ ลิตร
HClO 4 (aq) → H + (aq) + ClO 4 - (aq)
0.5 โมล 0.5 โมล 0.5 โมล
NaOH (aq) → Na + (aq) + OH - (aq)
0.1 โมล 0.1 โมล 0.1 โมล
การแตกตัวของกรดอ่อน
สารละลายกรดอ่อน เช่น กรดแอซิติก (CH 3COOH) เมื่อละลายน้ำ จะนำไฟฟ้าได้ไม่ดี ทั้งนี้ เพราะกรดแอซิติกแตกตัวเป็นไอออนได้เพียงบางส่วน เขียนแทนโดยสมการจะใช้ลูกศร ↔ เพื่อชี้ว่าปฏิกิริยาเกิดขึ้นทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ และอยู่ในภาวะสมดุลกัน เช่น CH 3COOH (aq) + H 2O (l) ↔ H 3O + (aq) + CH 3COO - (aq)
ปริมาณการแตกตัวของกรดอ่อน นิยมบอกเป็นร้อยละ เช่น กรด HA แตกตัวได้ร้อยละ 10 ในน้ำ หมายความว่า กรด HA 1 โมล เมื่อละลายน้ำ จะแตกตัวให้ H + เพียง 0.10 โมล
เปอร์เซ็นต์การแตกตัวของกรดอ่อน =
การแตกตัวของกรดของกรดอ่อนชนิดเดียวกัน จะเพิ่มขึ้นเมื่อสารละลายมีความเจือจางมากขึ้น เช่น กรดแอซิติก CH 3COOH ความเข้มข้นต่างกันจะมีเปอร์เซ็นต์การแตกตัวต่างกัน ดังนี้
CH 3COOH 1.0 M แตกตัวได้ 0.42 %
CH 3COOH 0.10 M แตกตัวได้ 1.30 %
CH 3COOH 0.010 M แตกตัวได้ 4.20 %
การแตกตัวของกรดมอนอโปรติก (monoprotic acid dissociation)
กรดมอนอโปรติก คือ กรดที่แตกตัวให้ H + ได้เพียง 1 ตัว เช่น HCOOH และ CH 3COOH
HCOOH (aq) → H + (aq) + HCOO - (aq)
CH 3COOH (aq) ↔ H + (aq) + CH 3COO - (aq)
การแตกตัวของกรดพอลิโปรติก (polyprotic acid dissociation )
กรดพอลิโปรติก หมายถึง กรดที่มีโปรตอนมากกว่า 1 ตัว และสามารถแตกตัวให้ H + ได้มากกว่า 1 ตัว ถ้าแตกตัวได้ H + 2 ตัว เรียกว่า กรดไดโปรติก เช่น H 2CO 3 , H 2S , H 2C 2O 4 เป็นต้น
H 2S ↔ H + + HS -
HS - ↔ H + + S 2-
H 2CO 3 ↔ H + + HCO 3 -
HCO 3 - ↔ H + + CO 3 2-
กรดที่แตกตัวให้ H + ได้ 3 ตัว เรียกว่า กรดไตรโปรติก เช่น H 3PO 4 , H 3PO 3
H 3PO 3 ↔ H + + H 2PO 4 -
H 2PO 4 - ↔ H + + HPO 4 2-
HPO 4 2- ↔ H + + PO 4 3-
pH ของสารละลาย
pH = -log [H 3O +]
หรือ [H 3O] + = 10 -pH
โดยที่ [H 3O +] คือ ความเข้มข้นของ H 3O + หรือ H + เป็นโมล/ ลิตร
น้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C จะมี [H 3O +] = 1 x 10 -7 โมล/ ลิตร
ดังนั้น pH = -log [H 3O +] = -log [1 x 10 -7] = 7
นั่นคือ pH ของน้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C เท่ากับ 7 ถือว่ามีสภาพเป็นกลาง คือไม่มีความเป็นกรดหรือเบส
ถ้า [H 3O +] = 1 x 10 -5 ; pH = -log [H 3O +] = -log [1 x 10 -5] = 5 ( เป็นกรด)
ถ้า [H 3O +] = 1 x 10 -9 ; pH = -log [H 3O +] = -log [1 x 10 -9] = 9 ( เป็นเบส)
ดังนั้นสรุปว่า
- pH < 7 สารละลายเป็นกรด
- pH = 7 สารละลายเป็นกลาง
- pH > 7 สารละลายเป็นเบส
นอกจากจะบอกความเป็นกรดเป็นเบสของสารละลายด้วยค่า pH แล้วยังสามารถบอกค่าความเป็นกรด- เบส ได้โดยใช้ค่า pOH
pOH ของสารละลาย คือ ค่าที่บอกความเข้มข้นของ OH - ในสารละลายมีค่าเท่ากับ -log[ OH -]
pOH = -log[ OH -]
โดย pH + pOH = 14
การแตกตัวเป็นไอออนของน้ำ
น้ำเป็นอิเล็กโทรไลต์ที่อ่อนมาก แตกตัวได้น้อยมาก ดังนั้น การนำไฟฟ้าของน้ำจะน้อย จนไม่สามารถตรวจสอบได้ด้วยการนำไฟฟ้าผ่านหลอดไฟ แต่ตรวจได้ด้วยเครื่องวัดกระแส ( เป็นแอมมิเตอร์)
ตัวอย่างการวัดการนำไฟฟ้าของน้ำชนิดต่างๆ ได้แก่ น้ำกลั่นที่อุณหภูมิห้อง น้ำกลั่นที่อุณหภูมิ 60 - 70 องศาเซลเซียส น้ำคลอง น้ำประปา และน้ำฝน จะได้ผลดังตาราง
ตาราง ตัวอย่างการนำไฟฟ้าของน้ำชนิดต่างๆ
น้ำชนิดต่างๆ | เครื่องตรวจการนำไฟฟ้า | วัดด้วยแอมมิเตอร์ |
| น้ำกลั่นที่อุณหภูมิห้อง น้ำกลั่นที่อุณหภูมิ 60-70 0C น้ำคลอง น้ำประปา น้ำฝน | หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง | 40 80 90 85 80 |
ตามทฤษฎีของเบรินสเตตและลาวรี น้ำทำหน้าที่เป็นทั้งกรดและเบส ไอออนที่เกิดขึ้นจากการแตกตัวของน้ำ และมีการถ่ายเทโปรตอนกันเองได้ ( ออโตไอออนไนเซชัน)
โมเลกุลของน้ำที่เสีย H + จะเปลี่ยนเป็น OH - ซึ่งมีประจุลบและโมเลกุลของน้ำที่ได้รับ H + จะเปลี่ยนเป็น H 3O + ซึ่งมีประจุบวก เราอาจเขียนสมการกรด- เบส ได้ง่ายๆ ดังนี้
H 2O (l) + H 2O (l) ↔ H 3O + (aq) + OH - (aq)
เนื่องจากระบบนี้อยู่ในภาวะสมดุล สามารถเขียนสมการค่าคงที่สมดุลของ H 2O ได้ดังนี้
การเปลี่ยนแปลงความเข้มข้นของไฮโดรเนียมไอออนและ ไฮดรอกไซด์ไอออนในน้ำ
จากที่กล่าวมาแล้ว น้ำแตกตัวให้ H 3O + และ OH - ได้เท่าๆ กัน ทำให้สภาพความเป็นกรด และสภาพความเป็นเบสเท่ากันตลอด หรือเรียกว่าเป็นกลาง โดยที่ K w = 1 x 10 -14 และ [H 3O +] เท่ากับ [ OH -] = 1 x 10 -7 แต่ความเข้มข้นของ H 3O + และ OH - นี้จะเปลี่ยนแปลงไปเมื่อเติม H 3O + หรือ OH - ลงไปในน้ำ
ถ้าเติม HCl ซึ่งเป็นอิเล็กโทรไลต์แก่ลงไปในน้ำ HCl จะแตกตัวให้ H 3O + และ Cl - ปริมาณ H 3O + ในน้ำจึงเพิ่มขึ้น
H 2O (l) + H 2O (l) ↔ H 3O + (aq) + OH - (aq)
HCl (l) + H 2O (l) → H 3O + (aq) + Cl - (aq)
ตามหลักของเลอชาเตอริเอ เมื่อ H 3O + มากขึ้น น้ำพยายามรักษาสมดุล โดยที่ H 3O + จะรวมกับ OH - เกิดปฏิกิริยาย้อนกลับ คือได้ H 2O มากขึ้น และ [ OH -] จะลดลง ปฏิกิริยาก็จะเข้าสู่ภาวะสมดุลอีกครั้งหนึ่ง
อินดิเคเตอร์สำหรับกรด-เบส
อินดิเคเตอร์ ส่วนใหญ่เป็นสารอินทรีย์มี สมบัติเป็นกรดอ่อน มีโครงสร้างซับซ้อนเป็นสารที่มีสีและสามารถเปลี่ยนสีได้เมื่อ pH ของสารละลายเปลี่ยนไป เป็นสารที่ใช้บอกความเป็นกรด-เบส ของสารละลายได้อย่างหนึ่ง ตามทฤษฎีของ Ostwald กล่าวว่าเมื่ออินดิเคเตอร์อยู่ในรูปโมเลกุลและเมื่อยู่ในรูปไอออนจะมีสีต่าง กันการเปลี่ยนสีของอินดิเคเตอร์
HIn เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปกรด (Acid form)In- เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปเบส (Basic form)
รูปกรดและรูปเบสมีภาวะสมดุล เขียนแสดงได้ด้วยสมการ ดังนี้
HIn (aq) + H2O (l) <--------> H3O+ (aq) + In- (aq)Kind =
HIn และ In- มีสีต่างกันและปริมาณต่างกัน จึงทำให้สีของสารละลายเปลี่ยนแปลงได้ ถ้าปริมาณ HIn มากก็จะมีสีของรูปกรด ถ้ามีปริมาณ In- มากก็จะมีสีของรูปเบส การที่จะมีปริมาณ HIn หรือ In มากกว่าหรือน้อยกว่านั้นขึ้นอยู่กับปริมาณ H3O+ ในสารละลาย ถ้ามี H3O+ มากก็จะรวมกับ In- ได้เป็น HIn ได้มาก แต่ถ้าอยู่ในสารละลายที่มี OH- มาก OH- จะทำปฏิกิริยากับ H3O+ ทำให้ H3O+ ลดลง ซึ่งจะมีผลทำให้เกิดปฏิกิริยาไปข้างหน้าได้ In- มากขึ้น
- เมื่อเติมกรด (H3O+) ทำให้ปริมาณ [H3O+] ทางขวาของสมการมีมากขึ้น ปฏิกิริยาจะเกิดย้อนกลับ ทำให้มี HIn มากขึ้นจึงเห็นเป็นสีของกรด HIn
- เมื่อเติมเบส (OH-) OH- จะทำปฏิกิริยากับ H3O+ ทำให้ H3O+ น้อยลง ปฏิกิริยาจะไปข้างหน้ามากขึ้น (®) ทำให้มี In- มากขึ้น จึงเห็นเป็นสีเบสของ In-
ถ้า [In-] > [HIn] 10 เท่าขึ้นไปจะเห็นสีของ In-
ความหมายของช่วง pH ของอินดิเคเตอร์
ช่วง pH ของอินดิเคเตอร์ หมายถึง ช่วง pH ของสารละลายที่อินดิเคเตอร์ค่อย ๆ เปลี่ยนสีจากสีหนึ่งไปยังอีกสีหนึ่ง หรือเป็นส่วน pH ที่อินดิเคเตอร์มีทั้งสีของ HIn และสีของ In- ผสมกัน ในการบอกช่วง pH ของอินดิเคเตอร์ จะต้องกำหนดสีที่เปลี่ยนด้วย เช่น
โบรโมไทมอลบลู ช่วง pH 6.0 – 7.6
การเปลี่ยนสี เหลือง – น้ำเงิน
หมายความว่า ถ้าสารละลายมี pH < 6.0 อินดิเคเตอร์จะให้สีเหลือง ถ้าสารละลายมี pH > 7.6 อินดิเคเตอร์จะให้สีน้ำเงิน และถ้าสารละลายมี pH อยู่ระหว่าง 6.0 – 7.6 อินดิเคเตอร์จะให้สีเขียว ซึ่งเป็นสีผสมของ HIn และ In-
การคำนวณเกี่ยวกับอินดิเคเตอร์
HIn (aq) + H2O (l) <-------> H3O+ (aq) + In- (aq)
KHln = [H3O+][ In- ] /[Hln]
[H3O+] = KHln [Hln] / [ In- ]
- log[H3O+] = - logKHln -log[Hln] / [ In- ]
pH = - logKHln -log[Hln] / [ In- ]
รูปกรด ; pH = pKHln – log10
pH = pKHln – 1
รูปเบส ; pH = pKHln + log10
pH = pKHln + 1
pH = pKHln + 1
KHln = [H3O+][ In- ] /[Hln]
[H3O+] = KHln [Hln] / [ In- ]
- log[H3O+] = - logKHln -log[Hln] / [ In- ]
pH = - logKHln -log[Hln] / [ In- ]
รูปกรด ; pH = pKHln – log10
pH = pKHln – 1
รูปเบส ; pH = pKHln + log10
pH = pKHln + 1
pH = pKHln + 1
ตัวอย่างสีของอินดิเคเตอร์แต่ละชนิด จะเปลี่ยนในช่วง pH ที่ต่างกัน

สารละลายบัฟเฟอร์
สารละลายบัฟเฟอร์ หมายถึง สารละลายที่ได้จากการผสมของกรดอ่อนกับคู่เบส ของกรดนั้น หรือเบสอ่อนกับคู่กรดของเบสนั้น จะได้สารละลายที่มีไอออนร่วม
หน้าที่สำคัญของสารละลายบัฟเฟอร์ คือเป็นสารละลายที่ ใช้ควบคุม ความเป็นกรดและเบสของสารละลาย เพื่อไม่ให้เปลี่ยนแปลงมาก เมื่อเติมกรดหรือเบสลงไปเล็กน้อย นั่นคือสามารถ รักษาระดับ pH ของสารละลายไว้ได้เกือบคงที่เสมอ แม้ว่าจะเติมน้ำหรือเติมกรดหรือเบสลงไปเล็กน้อย ก็ไม่ทำให้ pH ของสารละลายเปลี่ยนแปลงไปมากนัก เราเรียกความสามารถในการต้านทานการเปลี่ยนแปลง pH นี้ว่า buffer capacity
สารละลายบัฟเฟอร์มี 2 ประเภท
1) สารละลายของกรดอ่อนกับเกลือของกรดอ่อน (Acid buffer solution) สารละลายบัฟเฟอร์แบบนี้มี pH < 7 เป็นกรด เช่น
กรดอ่อน + เกลือของกรดอ่อนนั้น
CH3COOH + CH3COONa
HCN + KCN
H2S + Na2S
H2CO3 + NaHCO3
2) สารละลายของเบสอ่อนกับเกลือของเบสอ่อน (Basic buffer solution)
สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เป็นเบส เช่น
เบสอ่อน + เกลือของเบสอ่อนนั้น
NH3 + NH4Cl
NH3 + NH4NO3
Fe(OH)2 + FeCl2
Fe(OH)3 + FeCl3
วิธีเตรียมสารละลายบัฟเฟอร์ สารละลายบัฟเฟอร์ หมายถึง สารละลายที่ได้จากการผสมของกรดอ่อนกับคู่เบส ของกรดนั้น หรือเบสอ่อนกับคู่กรดของเบสนั้น จะได้สารละลายที่มีไอออนร่วม
หน้าที่สำคัญของสารละลายบัฟเฟอร์ คือเป็นสารละลายที่ ใช้ควบคุม ความเป็นกรดและเบสของสารละลาย เพื่อไม่ให้เปลี่ยนแปลงมาก เมื่อเติมกรดหรือเบสลงไปเล็กน้อย นั่นคือสามารถ รักษาระดับ pH ของสารละลายไว้ได้เกือบคงที่เสมอ แม้ว่าจะเติมน้ำหรือเติมกรดหรือเบสลงไปเล็กน้อย ก็ไม่ทำให้ pH ของสารละลายเปลี่ยนแปลงไปมากนัก เราเรียกความสามารถในการต้านทานการเปลี่ยนแปลง pH นี้ว่า buffer capacity
สารละลายบัฟเฟอร์มี 2 ประเภท
1) สารละลายของกรดอ่อนกับเกลือของกรดอ่อน (Acid buffer solution) สารละลายบัฟเฟอร์แบบนี้มี pH < 7 เป็นกรด เช่น
กรดอ่อน + เกลือของกรดอ่อนนั้น
CH3COOH + CH3COONa
HCN + KCN
H2S + Na2S
H2CO3 + NaHCO3
2) สารละลายของเบสอ่อนกับเกลือของเบสอ่อน (Basic buffer solution)
สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เป็นเบส เช่น
เบสอ่อน + เกลือของเบสอ่อนนั้น
NH3 + NH4Cl
NH3 + NH4NO3
Fe(OH)2 + FeCl2
Fe(OH)3 + FeCl3
1. เตรียมโดยตรงโดยการผสมกรดอ่อนกับคู่เบสของกรดนั้นหรือผสมเบสอ่อนกับคู่กรด ของเบสนั้นก็จะได้เกลือของกรดอ่อนและเกลือของเบสอ่อน
2. เตรียมจากปฏิกิริยาระหว่างกรดกับเบส ดังนี้
1) บัฟเฟอร์กรด เตรียมโดยใช้กรดอ่อน( แตกตัวบางส่วน )ทำปฏิกิริยากับเบส (แก่หรืออ่อน)
เช่น HF(aq) + NaOH(aq) -----------------> NaF(aq) + H2O(l)
ถ้าใช้ HF มากเกินพอ เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้ว NaOH จะหมดไปจากระบบดังนั้นในระบบจะเป็นสารละลายผสมระหว่าง HF กับ NaF ซึ่งเป็นบัฟเฟอร์กรด (กรดอ่อน+เกลือของมัน)
2) บัฟเฟอร์เบส เตรียมโดยใช้เบสอ่อน( แตกตัวบางส่วน ) ทำปฎิกิริยากับกรด (แก่หรืออ่อน) เช่น
HCl(aq) + NH4OH(aq) ----------------> NH4Cl(aq) + H2O(l)
ถ้าใช้ NH4OH มากเกินพอ เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว HCl จะหมดไปจากระบบดังนั้นในระบบจะเป็นสารละลายผสมระหว่าง NH4OH กับ NH4Cl ซึ่งเป็นบัฟเฟอร์เบส (เบสอ่อน + เกลือของมัน)
การควบคุมค่า pH ของสารละลายบัฟเฟอร์
ถ้าบัฟเฟอร์มีสาร CH3COO- กับ CH3COOH อยู่ในระบบ ถ้าเติมกรด เช่น HCl ลงไป H+ ในกรดจะถูกสะเทินด้วยคู่เบสดังนี้
CH3COO- + H+ ↔ CH3COOH
ถ้าเติมเบส เช่น KOH ลงไป OH- ในเบสจะถูกสะเทินด้วยคู่กรณีดังนี้
CH3COOH + OH- ↔ CH3COO- + H2O
สรุปได้ว่า - ถ้าเติมกรดลงไป H+ ในกรดจะถูกสะเทินด้วยเบส
- ถ้าเติมเบสลงไป OH- ในเบสจะถูกสะเทินด้วยกรด
- กรดแก่ เบสแก่ เป็นบัฟเฟอร์ไม่ได้เพราะสารพวกนี้แตกตัวได้ 100% ไม่มีโอกาสเกิดคู่กรดคู่เบส
ชนิดของ Buffer
1.คู่เหมือนไม่ทำปฏิกิริยากัน เช่น CH3COOH กับ CH3COONa
2.บัฟเฟอร์คู่กรด คู่เบส ของกรดอ่อนกับเกลือของกรดอ่อน
3. บัฟเฟอร์คู่กรด คู่เบส ของเบสอ่อนกับเกลือของเบสอ่อน
หลักการการดูสารว่าเป็น Buffer หรือไม่
1.ถ้าไม่ทำปฏิกิริยากัน(คู่เหมือน)ตัดแก่ออกจะต้องมี H+ ต่างกัน 1ตัว
2.ถ้าทำปฏิกิริยากันอ่อนต้องเหลือ
การดูค่า pH ของ สารละลายBuffer
1.บัฟเฟอร์ที่เกิดจากกรดอ่อนคู่กับเกลือของกรดอ่อน มี pH <7 เป็นกรด
2.บัฟเฟอร์ที่เกิดจากเบสอ่อนคู่กับเกลือของเบสอ่อน มี pH >7 เป็นเบส
สูตรที่ใช้ในการหาค่า PH และ POH1.คู่เหมือนไม่ทำปฏิกิริยากัน เช่น CH3COOH กับ CH3COONa
2.บัฟเฟอร์คู่กรด คู่เบส ของกรดอ่อนกับเกลือของกรดอ่อน
3. บัฟเฟอร์คู่กรด คู่เบส ของเบสอ่อนกับเกลือของเบสอ่อน
หลักการการดูสารว่าเป็น Buffer หรือไม่
1.ถ้าไม่ทำปฏิกิริยากัน(คู่เหมือน)ตัดแก่ออกจะต้องมี H+ ต่างกัน 1ตัว
2.ถ้าทำปฏิกิริยากันอ่อนต้องเหลือ
การดูค่า pH ของ สารละลายBuffer
1.บัฟเฟอร์ที่เกิดจากกรดอ่อนคู่กับเกลือของกรดอ่อน มี pH <7 เป็นกรด
2.บัฟเฟอร์ที่เกิดจากเบสอ่อนคู่กับเกลือของเบสอ่อน มี pH >7 เป็นเบส
pHของ Buffer ใช้สูตร
เมื่อ A- = ความเข้มข้นของเกลือ
HA = ความเข้มข้นเริ่มต้นของกรด
pOHของ Buffer ใช้สูตร pOH = -logKb + log [เกลือ]/[เบส]
**** สารละลายบัฟเฟอร์จะมีประสิทธิภาพดีที่สุดเมื่อ [HA] = [A-] ซึ่งจะทำให้ [H+] = Ka ด้วยเหตุนี้จึงเลือกใช้บัฟเฟอร์ที่มีค่า pKaใกล้เคียงกับ pH ที่ต้องการเตรียม****
การไทเทรตกรด – เบส
การไทเทรต กรด - เบส (Acid-Base Titration)
เป็นกระบวนการวิเคราะห์หาปริมาณของกรดหรือเบส โดยให้สารละลายกรดหรือเ บสทำปฏิกิริยาพอดีกับสารละลายมาตรฐาน เบสหรือกรดซึ่งทราบความเข้มข้นที่แน่นอน และใช้อินดิเคเตอร์เป็นสารที่บอกจุดยุติ ด้วยการสังเ กตจากสีที่เปลี่ยน ขณะไทเทรต pH จะเปลี่ยนไป ถ้าเลือกใช้อินดิเคเตอร์เหมาะสม จะบอกจุดยุติใกล้เคียงกับจุดสมมูลจุดสมมูล ( จุดสะเทิน = Equivalence point)
คือจุดที่กรดและเบสทำปฏิกิริยาพอดีกัน จุดสมมูลจะมี pH เป็นอย่างไร< wbr> นั้นขึ้นอยู่กับชนิดของกรดและเบสที่นำมาไทเทรตกัน และขึ้นอยู่กับความเข้มข้นของกรดและเบสจุดยุติ (End point)
คือจุดที่อินดิเคเตอร์เปลี่ยนสี ขณะไทเทรตกรด- เบสอยู่ จุดยุติจะใกล้เคียงกับจุดสมมูลได้นั้น จะ ต้องเลือกอินดิเคเตอร์เหมาะสม ในทางปฏิบัติถือว่าจุดยุติ เป็นจุดเดียวกับจุดสมมูลจุดยุติ (End point)
การที่จะทราบว่า ปฏิกิริยาการไทเทรตถึงจุดสมมูลหรือยังนั้น จะต้องมีวิธีการที่จะหาจุดสมมูล วิธีการหนึ่งคือ การใช้อินดิเคเตอร์ โดยอินดิเคเตอร์จะต้องเปลี่ยนสีที่จุดที่พอดีหรือใกล้เคียงกับจุดสมมูล นั่นคือ จุดที่อินดิเคเตอร์เปลี่ยนสี จะเรียกว่า จุดยุติ
การหาความเข้มข้นของกรดไฮโดรคลอริก โดยการไทเทรตชัน
a) ตวงปริมาตรของสารละลายกรดด้วยปิเปดต์ใส่ขวดชมพู่b) ไทเทรตสารละลายมาตรฐานจากบิวเรตต์ลงในขวดชมพู่ที่มีสารละลายกรดไฮโดรคลอริกอยู่ด้วย
c) การไทเทรตกรด- เบสจนถึงจุดยุติโดยสังเกตจากอินดิเคเตอร์เปลี่ยนสี
d) อ่านปริมาตรของสารละลายเบส ( สารละลายมาตรฐาน) ที่ใช้ในการทำปฏิกิริยาพอดีกับสารละลายกรดนี้ บันทึกข้อมูล
วิธีการไทเทรตกรด - เบส คือ นำสารละลายกรดหรือเบสตัวอย่างที่ต้องการวิเคราะห์หาปริมาณ มาทำการไทเทรตกับสารละลายเบสหรือกรดมาตรฐานที่ทราบค่าความเข้มข้นที่แน่นอน กล่าวคือ ถ้าสารละลายตัวอย่างเป็นสารละลายกรด ก็ต้องใช้สารละลายมาตรฐานเป็นเบส นำมาทำการไทเทรต แล้วบันทึกปริมาตรของสารละลายมาตรฐานที่ใช้ในการทำปฏิกิริยาพอดีกัน จากนั้นนำไปคำนวณหาปริมาณของสารตัวอย่างต่อไป หรือทางตรงกันข้าม ถ้าใช้สารละลายตัวอย่างเป็นเบส ก็ต้องใช้สารละลายมาตรฐานเป็นกรด
ตัวอย่างเช่น การหาค่าสารละลายกรด HCl ว่ามีความเข้มข้นเท่าใดเราอาจใช้สารละลายมาตรฐาน NaOH เข้มข้น 0.100 โมล/ ลิตร มาทำการไทเทรตกับสารละลาย HCl ตัวอย่าง จำนวนหนึ่ง ( อาจจะเป็น 50 cm 3 ) เมื่อทราบปริมาตรของ NaOH ที่ใช้ในการทำปฏิกิริยาพอดีกับ HCl จำนวน 50 cm 3 นี้โดยอินดิเคเตอร์เป็นตัวบอกจุดยุติ แล้วเราก็สามารถคำนวณหาความเข้มข้นของกรด HCl ได้
  รูปที่ 1 การไทเทรตกรด- เบส |
เครื่องแก้วเชิงปริมาตร ที่ใช้ในการถ่ายเทของเหลวตัวอย่าง ลงในขวดรูปกรวยจะใช้เครื่องแก้วที่สามารถ อ่านปริมาตรได้ค่าที่ละเอียด และมีค่าถูกต้องมากที่สุด นั่นคือจะใช้ ปิเปตต์ ( จะไม่ใช้กระบอกตวงเพราะให้ค่าที่ไม่ละเอียด และความถูกต้องน้อย) ซึ่งมีขนาดต่างๆ ให้เลือกใช้ เช่น ขนาด 1 cm 3 , 5, 10, 25, 50 cm 3 เป็นต้น วิธีใช้ปิเปตต์จะใช้ลูกยางช่วยในการดูดสารละลาย โดยในตอนแรก บีบอากาศออกจากลูกยาง ที่อยู่ปลายบนของปิเปตต์ แล้วจุ่มปลายปิเปตต์ ลงในสารละลายที่ต้องการปิเปตต์ แล้วค่อยๆ ปล่อยลูกยาง สารละลายจะถูกดูดขึ้นมาในปิเปตต์ เมื่อสารละลายอยู่เหนือขีดบอกปริมาตร ดึงลูกยางออก รีบใช้นิ้วชี้กดที่ปลายปิเปตต์ค่อยๆ ปล่อยสารละลายออกจนถึงขีดบอกปริมาตรบน จากนั้นก็ปล่อยสารละลาย ออกจากปิเปตต์สู่ขวดรูปกรวยจนหมด
ปฏิกิริยาในการไทเทรตกรด - เบส
ปฏิกิริยา ที่เกี่ยวข้อง ในการไทเทรตกรด- เบสต่างๆ ได้แก่
1. ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
2. ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
3. ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
สำหรับปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อนไม่นิยมนำมาใช้ในการไทเทรตกรด- เบส เพราะที่จุดสมมูล หรือจุดที่กรดและเบสทำปฏิกิริยาพอดีกัน สังเกตการเปลี่ยนแปลงได้ไม่ชัดเจน
ปฏิกิริยาระหว่างกรด- เบส เขียนแทนด้วยสมการ
H + (aq) + OH - (aq)
การคำนวณเกี่ยวกับการไทเทรตกรด - เบส
การคำนวณเกี่ยวกับการไทเทรต จะเกี่ยวข้องกับการคำนวณต่อไปนี้
1. การคำนวณความเข้มข้นของกรดหรือเบสที่เข้าทำปฏิกิริยากันพอดี
ปริมาณของกรดหรือเบสจะคำนวณได้จากปริมาณสัมพันธ์ในสมการของปฏิกิริยาระหว่างกรดและเบส m กรด + n เบส
จากปฏิกิริยาอัตราส่วนระหว่างกรดและเบสเป็นดังนี้
หรือ
M aV a =
เมื่อ
M a , M b คือ ความเข้มข้นเป็น โมล/ ลิตร ของกรดและเบส ตามลำดับ
V a , V b คือ ปริมาตรเป็น ลิตร ของสารละลายกรดและเบส ตามลำดับ
m , n คือ จำนวนโมลของกรดและเบส ตามลำดับ
2. การคำนวณเกี่ยวกับ pH ของสารละลายและการสร้างกราฟของการไทเทรต
กราฟของการไทเทรต
เป็นกราฟที่ได้จากการเขียนระหว่าง pH ของสารละลายที่เปลี่ยนไปขณะไทเทรต กับปริมาตรของสารละลายมาตรฐาน จะได้กราฟที่มีรูปร่างเปลี่ยนแปลง ขึ้นอยู่กับความแรงของกรด และเบสที่เกี่ยวข้องในการทำไทเทรต ความเข้มข้นของกรดและเบส สภาวะที่เกิดเป็นบัฟเฟอร์ และการเกิดไฮโดรไลซีสของเกลือ จุดประสงค์ของการเขียนกราฟของการไทเทรต เพื่อศึกษาดูว่า การไทเทรตระหว่างกรด- เบสคู่นั้นจะทำได้หรือไม่ และยังใช้เป็นส่วนหนึ่งในการเลือกใช้อินดิเคเตอร์อีกด้วย ซึ่งกราฟของการไทเทรตนี้ แบ่งออกได้เป็น 3 ช่วง คือ
1. ก่อนถึงจุดสมมูล
2. ที่จุดสมมูล จำนวนโมลของกรดจะทำปฏิกิริยาพอดีกับเบส
3. หลังจุดสมมูล
1. การไทเทรตระหว่างกรดแก่กับเบสแก่
การไทเทรตกรดแก่ด้วยเบสแก่นั้น ทั้งกรดแก่และเบสแก่ต่างก็แตกตัวได้หมด ตัวอย่างเช่น การไทเทรตสารละลายกรดเกลือ (HCl) ด้วยสารละลายมาตรฐานเบส NaOH ปฏิกิริยาที่เกิดขึ้นคือ

HCl(aq) + NaOH(aq) ฎ H 2O (l) + NaCl (aq)
การไทเทรตระหว่างกรดแก่และเบสแก่ สารละลายผลิตภัณฑ์ที่ได้เป็นเกลือที่ไม่เกิดปฏิกิริยาไฮโดรไลซีส ดังนั้น การหาค่า pH ก็คำนวณจากปริมาณ H 3O + หรือ OH - ที่มีอยู่ในสารละลายนั้นโดยตรงและมี pH ของสารละลายเท่ากับ 7
. การไทเทรตระหว่างกรดอ่อนกับเบสแก่
การไทเทรตกรดอ่อนกับเบสแก่ เช่น กรดแอซิติก (CH 3COOH) กับโซเดียมไฮดรอกไซด์ (NaOH) เมื่อถึงจุดสมมูล สารละลายที่ได้จะมีโซเดียมแอซิเตต ซึ่งเกิดไฮโดรไลซีสได้ และสารละลายจะมี pH > 7

3. การคำนวณ pH ของสารละลายจากปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
การไทเทรตกรดแก่กับเบสอ่อน เช่น กรด HCl กับ NH 3 จะได้เกลือ NH 4Cl ซึ่งเกิดไฮโดรไลซีสได้สารละลายที่เป็นกรดมี pH < 7 ที่จุดสมมูล

การไทเทรตกรดพอลิโปรติก
กรดโพลิโปรติกสามารถให้โปรตอน (H +) กับเบสได้มากกว่า 1 โปรตอน ตัวอย่างเช่น กรดซัลฟิวริก (H 2SO 4) เป็นกรดไดรโปรติก ให้โปรตอนได้ 2 ตัว กรดฟอสฟอริก (H 3PO 4) เป็นกรดไตรโปรติก ใหโปรตอนได้ 3 ตัว สมการแสดงภาวะสมดุลของกรดพอลิโปรติก สามารถเขียนได้ดังนี้
HM - + H 2O
H 2M เป็นกรดไดโปรติก มีค่าคงที่การแตกตัว K 1 และ K 2 ในการไทเทรตกรไดโปรติกนี้กับเบสกรดจะทำปฏิกิริยากับเบสเป็น 2 ขั้นด้วยกัน และมีจุดสมมูลเกิดขึ้น 2 จุดด้วยกัน
- จุดสมมูลที่หนึ่ง โปรตอนตัวแรกทำปฏิกิริยาพอดีกับเบส
- จุดสมมูลที่สอง โปรตอนตัวที่สองทำปฏิกิริยาพอดีกับเบส
อินดิเคเตอร์กับการไทเทรตกรด - เบส
อินดิเคเตอร์กรด- เบส ที่เหมาะสมกับปฏิกิริยาการไทเทรตจะต้องมีค่า pH ที่จุดกึ่งกลางช่วงการเปลี่ยนสีใกล้เคียงหรือเท่ากับ pH ที่จุดสมมูลของปฏิกิริยา นอกจากนี้ การเลือกใช้อินดิเคเตอร์กรด- เบส ต้องพิจารณาสีที่ปรากฎ จะต้องมีความเข้มมากพอที่จะมองเห็นได้ง่าย หรือเห็นการเปลี่ยนสีได้ชัดเจน ช่วงการเปลี่ยนสีของอินดิเคเตอร์ จะเกิดขึ้นในช่วง 2 หน่วย pH
การประยุกต์การไทเทรตกรด - เบสเพื่อหาปริมาณสารในชีวิตประจำวัน
การไทเทรตกรด- เบส ใช้ประยุกต์หาปริมาณสารที่เป็นสารอินทรีย์ สารอนินทรีย์
และสารชีวโมเลกุลได้
ตัวอย่างการประยุกต์ใช้ ได้แก่ การหาปริมาณกรดอ่อนในน้ำส้ม น้ำมะนาว และในไวน์ การหาปริมาณเบส Mg(OH) 2 , MgO ในยาลดกรด หรือการหาปริมาณโปรตีนในอาหาร
- การหาปริมาณกรดอ่อนในน้ำสม ทำได้โดยการปิเปตต์น้ำส้มเจือจางด้วยน้ำกลั่นประมาณ 5 เท่า แล้วไทเทรตกับสารละลายมาตรฐาน NaOH เข้มข้น 0.1000 M โดยใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์ ไทเทรตจนสารละลายเปลี่ยนจากไม่มีสีเป็นสีชมพู แล้วคำนวณหาร้อยละของกรดแอซิติก (CH 3COOH) โดยมวลต่อปริมาตร
- การหาปริมาตรกรดอ่อนในมะนาวและในไวน์ ก็ทำได้โดยวิธีเดียวกับการหาปริมาณกรดแอซิติกในน้ำส้ม การรายงานผล จะรายงานเป็นร้อยละของกรดแอซิติก ( ในน้ำมะนาว) และกรดทาร์ทาริก ( ในไวน์)
- การหาปริมาณ Mg(OH) 2 ก็ทำได้โดยการไทเทรตกับสารละลายมาตรฐานโดยตรง เช่น ไทเทรตกับกรด HCl สำหรับการหาปริมาณ MgO จะต้องเปลี่ยนให้เป็น Mg(OH) 2 โดยการใช้เบส แล้วค่อยไทเทรตกับสารละลายกรดมาตรฐาน
- การหาปริมาณโปรตีนในอาหาร ต้องใช้วิธีทางอ้อมในการวิเคราะห์ โดยการหาปริมาณไนโตรเจนที่อยู่ในเอมีน ซึ่งเป็นกรดอะมิโนในโปรตีน การหาปริมาณไนโตรเจนนี้ทำได้โดยการเปลี่ยนไนโตรเจนให้อยู่ในรูปของ NH 3 แล้วไทเทรตกับสารละลายมาตรฐาน


ไม่มีความคิดเห็น:
แสดงความคิดเห็น